2024年高考的临近,化学作为理科生的一门重要科目,掌握基础知识对于考生来说也是关键的一步。本文将对高考化学中的必备基础知识进行梳理,帮助考生们更好地备考。
化学必考点
1. 混合物的分离
①过滤:固体(不溶)和液体的分离。
②蒸发:固体(可溶)和液体分离。
③蒸馏:沸点不同的液体混合物的分离。
④分液:互不相溶的液体混合物。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
2. 粗盐的提纯
(1)粗盐的成分:主要是NaCl,还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质
(2)步骤:
①将粗盐溶解后过滤;
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;
④蒸发、结晶得到精盐。
加试剂顺序关键:Na2CO3在BaCl2之后;盐酸放最后。
(3) 蒸馏装置注意事项:
①加热烧瓶要垫上石棉网;
②温度计的水银球应位于蒸馏烧瓶的支管口处;
③加碎瓷片的目的是防止暴沸;
④冷凝水由下口进,上口出。
(4) 从碘水中提取碘的实验时,选用萃取剂应符合原则:
①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;
②萃取剂与原溶液溶剂互不相溶;
③萃取剂不能与被萃取的物质反应。
3. 离子的检验
①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉淀,原溶液中一定含有SO42-。Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成,再加稀硝酸沉淀不溶解,原溶液中一定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉淀生成,则原溶液中一定含有Cl-。Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀,再加稀盐酸,沉淀溶解,并生成无色无味、能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-。
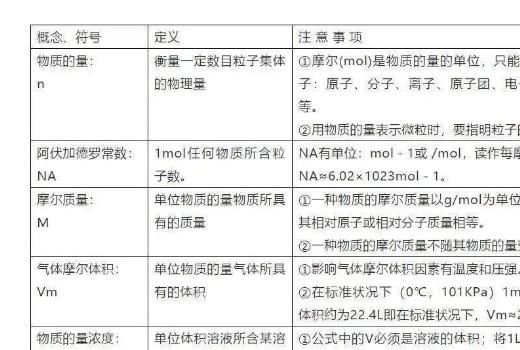
4. 5个新的化学符号及关系
5. 分散系
(1)分散系组成:分散剂和分散质,按照分散质和分散剂所处的状态,分散系可以有9种组合方式。
(2)当分散剂为液体时,根据分散质粒子大小可以将分散系分为溶液、胶体、浊液。
6. 胶体
(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。区别胶体与其他分散系常用方法丁达尔效应。
胶体与其他分散系的本质区别是分散质粒子大小。
(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
7.电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不能导电的化合物。(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。)
8. 电解质和非电解质相关性质
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)酸、碱、盐和水都是电解质(特殊:盐酸(混合物)电解质溶液)。
(3)能导电的物质不一定是电解质。能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
溶液能够导电的原因:有能够自由移动的离子。
电离方程式:要注意配平,原子个数守恒,电荷数守恒。如:Al2(SO4)3=2Al3++3SO42-
9. 离子反应
(1)离子反应发生的条件:生成沉淀、生成气体、水。
(2)离子方程式的书写:(写、拆、删、查)
①写:写出正确的化学方程式。(要注意配平。)
②拆:把易溶的强电解质(易容的盐、强酸、强碱)写成离子形式,这些物质拆成离子形式,其他物质一律保留化学式。
③删:删除不参加反应的离子(价态不变和存在形式不变的离子)。
④查:检查书写离子方程式等式两边是否原子个数守恒、电荷数守恒。
10. 常见易溶的强电解质
三大强酸(H2SO4、HCl、HNO3),四大强碱[NaOH、KOH、Ba(OH)2、Ca(OH)2 (澄清石灰水拆,石灰乳不拆)],可溶性盐。
2024年高考化学必考知识点
1. 化学基础知识
原子与元素:原子结构、元素周期表、元素的性质与分类。
化学键与化合物:离子键、共价键、金属键,化合物的命名与化学式写法。
化学反应:化学反应的基本类型、化学平衡、化学方程式的平衡写法与判定。
2. 物质的组成与结构
基本粒子:质子、中子、电子,质子数、中子数、电子数的关系。
原子结构:原子核、电子壳层结构,电子的排布规律(阿布居尔定律)。
元素周期表:元素周期表的组成、元素周期表的特点,周期表中的周期性规律。
化学键与分子结构:离子键、共价键、金属键,分子的形状与性质。
3. 化学变化与能量
化学反应的能量变化:焓变、吸热反应与放热反应,化学反应中的能量守恒原理。
化学反应速率:反应速率与反应条件的关系,影响反应速率的因素。
化学平衡:平衡常数、平衡常数与温度的关系,影响平衡位置的因素。
4. 酸碱与盐
酸碱理论:酸碱的定义、酸碱中离子的生成与反应。
酸碱性与pH值:酸碱的判定、酸碱溶液的浓度及pH值。
盐与酸碱中性化反应:盐的命名与性质,酸碱中性化反应的判定与计算。
5. 化学反应的平衡
平衡态的表达与判定:化学平衡的判定、平衡常数的计算。
化学平衡条件:化学平衡的条件、平衡常数与温度的关系。
化学反应的平衡常数:平衡常数的定义、计算方法与应用。
6. 电化学与电解质
电解质溶液:电解质的概念、强电解质与弱电解质。
离子在溶液中的行为:离子的迁移、电解质的电解。
电化学电池:电化学电池的基本概念、电动势的计算和性质。
7. 化学反应动力学
化学反应速率:化学反应速率的概念、速率定律,速率与浓度的关系。
催化剂:催化作用的原理与应用。
反应平衡与速率:平衡与速率的关系,平衡与速率的偏离与调节。
8. 化学材料科学
材料的种类与性质:金属材料、聚合物材料、无机非金属材料。
材料的制备与应用:金属的提取、聚合物的合成、合成材料的应用。
化学材料的特殊性质:超导性、光电性、磁性等特殊性质的材料。
9. 化学与人类社会
化学史与化学进展:化学的起源与发展,化学技术对社会的影响与进展。
化学与环境保护:污染物与环境的关系,化学方法的环境保护应用。
化学与生命科学:生物大分子、生物催化与生物合成等生命化学现象。
